30. 配位化合物 K3[Fe(CN)6]、[Cr(NH3)4Br2]Br、[Ni(H2O)6]Cl2、Na2[TaF7]的中心金屬氧化數依序為
(A) ‒3, 3, 2, 5
(B) 3, 3, 2, 7
(C) 3, 3, 2, 5
(D) 以上皆非
(A) ‒3, 3, 2, 5
(B) 3, 3, 2, 7
(C) 3, 3, 2, 5
(D) 以上皆非
答案:登入後查看
統計: A(7), B(12), C(403), D(10), E(0) #2905444
統計: A(7), B(12), C(403), D(10), E(0) #2905444
詳解 (共 3 筆)
#6336778
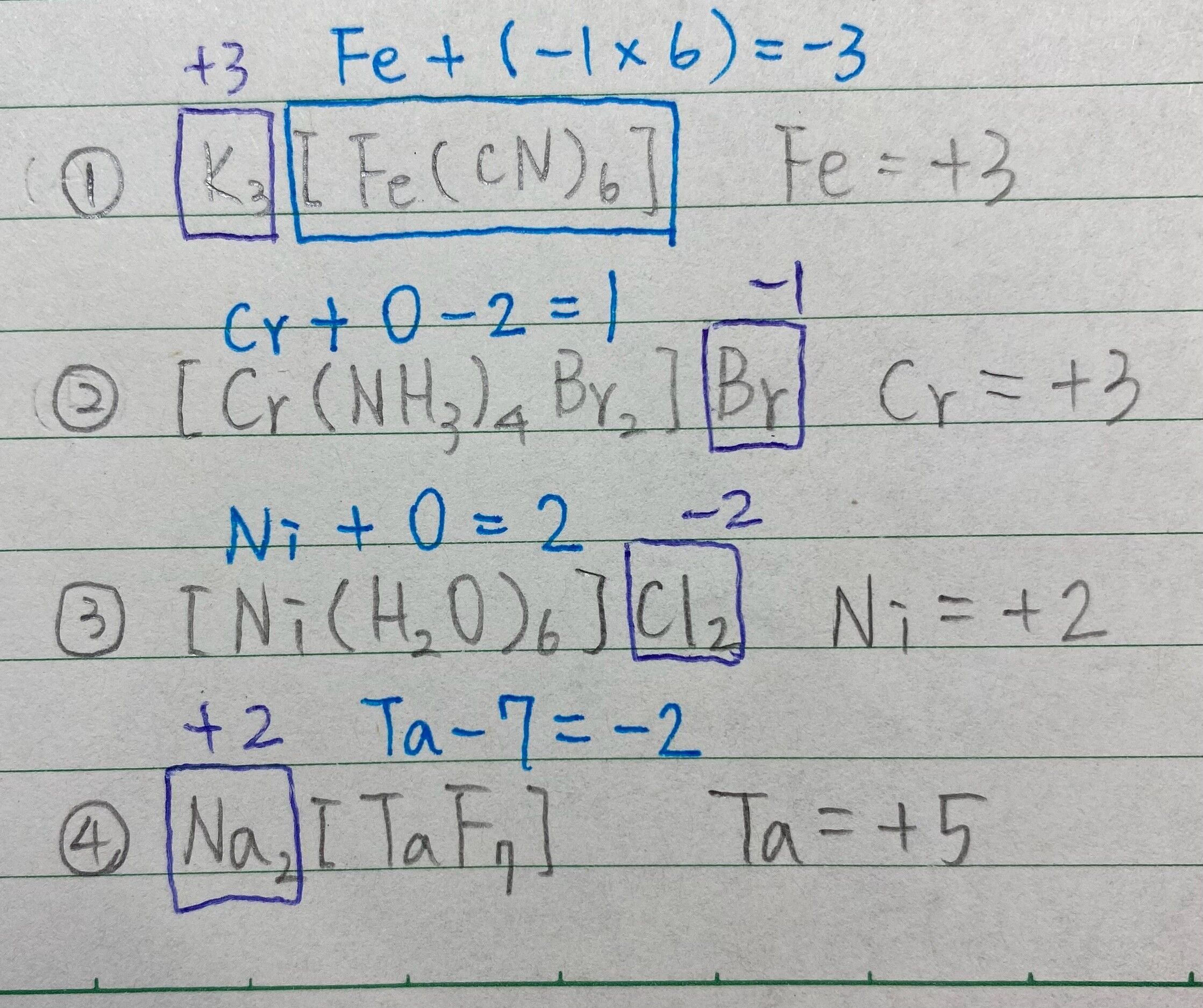
4
0
#6061101
要確定配位化合物中心金屬的氧化數,我們可以通過配位子的電荷和已知配位化合物的電中性來推斷。
-
K3[Fe(CN)6]: 氰化物配位子 CN- 的總電荷為 -1,K+ 離子的電荷為 +1。因此,Fe 的氧化數為 +3。
-
[Cr(NH3)4Br2]Br: 銨離子 NH3 和溴離子 Br- 沒有帶電,因此銅離子 Cr 的氧化數必須與溴離子 Br- 的電荷相抵消。每個溴離子帶 -1 電荷,所以 Cr 的氧化數為 +3。
-
[Ni(H2O)6]Cl2: 水配位子 H2O 和氯離子 Cl- 沒有帶電,所以鎳離子 Ni 的氧化數必須與氯離子 Cl- 的電荷相抵消。每個氯離子帶 -1 電荷,所以 Ni 的氧化數為 +2。
-
Na2[TaF7]: 氟化物配位子 F- 的總電荷為 -1,Na+ 離子的電荷為 +1。因此,Ta 的氧化數為 +5。
根據上述計算,這些配位化合物中心金屬的氧化數依序為:
(C) 3, 3, 2, 5
3
0