四、考慮活性(activities)的鉛酸電瓶(lead-acid battery)問題:用來啟動汽車 的一個 12 V 鉛酸電瓶是由 6 個 2 V 的電池組成。第一個可充電電瓶是在 1859 年由法國物理學家 Gaston Plante 在 25 歲發明的。它的電極是一個具 有大表面積的金屬鉛網(lead grids)。固體 PbO2是被壓在陰極(cathode) 上。電池充滿 H2SO4水溶液,當電充滿時,它是~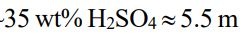 (重量莫耳濃度)(~ 4.4 M 體積莫耳濃度)。在放電過程(當電瓶正在產電 時),Pb 在陽極(anode)被氧化成 PbSO4(s)。在陰極,PbO2 被還原成 PbSO4(s)。當電池放電,兩個電極會被塗覆 PbSO4(s)。兩個反應都會消耗 H2SO4 ,其濃度在放電過程會減至~
(重量莫耳濃度)(~ 4.4 M 體積莫耳濃度)。在放電過程(當電瓶正在產電 時),Pb 在陽極(anode)被氧化成 PbSO4(s)。在陰極,PbO2 被還原成 PbSO4(s)。當電池放電,兩個電極會被塗覆 PbSO4(s)。兩個反應都會消耗 H2SO4 ,其濃度在放電過程會減至~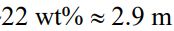 。
。
Cathode(陰極):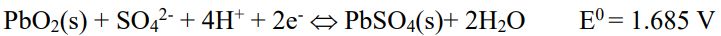
Anode(陽極):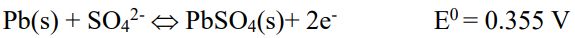
(三)對一個完全充電的鉛酸電瓶,寫出每一個半反應的能士特(Nernst)方 程式,包括活性係數(activity coefficients)。在能士特方程式的溶質濃 度,將其表示為重量莫耳濃度,m。在一個完全充電的電瓶,電解質濃 度為 5.5 m H2SO4(35 wt% H2SO4)。固體的活性為 1。但是,在 35 wt% H2SO4 中 H2O 的活性(activity)不是 1,因為酸的濃度很大。對於水, 其活性可表為 A_H2O = m_H2O γ_H2O,對於硫酸鹽,其活性可表為  ,而對於H+,其活性可表為A_H⁺ = m_H⁺ γ_H⁺。
,而對於H+,其活性可表為A_H⁺ = m_H⁺ γ_H⁺。